抗RSウイルスモノクローナル抗体として開発中のクレスロビマブ(MK-1654)により 健康な早産児および正期産児のRSウイルス感染症の発生率と入院率が有意に低下
2024/11/07 15:02 JST
報道関係各位
MSD株式会社
この参考資料は、Merck’s Clesrovimab (MK-1654), an Investigational Respiratory Syncytial Virus (RSV) Preventative Monoclonal Antibody, Significantly Reduced Incidence of RSV Disease and Hospitalization in Healthy Preterm and Full-term Infants (https://www.merck.com/news/mercks-clesrovimab-mk-1654-an-investigational-respiratory-syncytial-virus-rsv-preventative-monoclonal-antibody-significantly-reduced-incidence-of-rsv-disease-and-hospitalization-in-heal/) の日本語訳であり、内容や解釈については英語が優先されます。適応症や安全性情報、疫学情報も米国のものであり、日本国内の情報ではありません。
Clesrovimab (MK-1654)は、日本国内ではクレスロビマブ (MK-1654)として開発中の段階です。
参考資料
抗RSウイルスモノクローナル抗体として開発中のクレスロビマブ(MK-1654)により 健康
な早産児および正期産児のRSウイルス感染症の発生率と入院率が有意に低下
第2b/3相試験において、クレスロビマブにより、
5カ月目までのRSウイルス関連の入院(副次評価項目)および
RSウイルス関連の下気道感染症による入院(三次評価項目)が
それぞれ84%、90%を超える低下
クレスロビマブは、乳児の体重に関わらず1回の投与で生後初回のRSウイルス感染流行期での
感染予防を目的に設計された唯一かつ初めての予防薬 となる可能性
2024年10月17日:ニュージャージー州ローウェイ Merck & Co., Inc., Rahway, NJ, USA(米国とカナダ以外ではMSD)は本日、生後初回のRSウイルス(respiratory syncytial virus: RSV)感染流行期を迎える乳児のRSウイルス感染症を予防するモノクローナル抗体として開発中のクレスロビマブを評価する第2b/3相試験(MK-1654-004)の良好な結果を公表したことを発表しました。この試験の結果は、現在進行中のクレスロビマブの第3相試験(MK-1654-007)の中間解析結果と合わせて、カリフォルニア州ロサンゼルスで10月16〜19日に開催されているIDWeek 2024で発表されました。
健康な早産児および正期産児(出生から1歳を迎えるまで)を対象にクレスロビマブの単回投与を評価するプラセボ対照第2b/3相試験のMK-1654-004では、事前に規定されたすべての評価項目を達成し、5カ月および6カ月の時点で一貫した結果が得られました。有害事象(AE)および重篤な有害事象の発現率は、クレスロビマブ群とプラセボ群で同程度であり、試験期間中、治療関連またはRSウイルス関連の死亡例はありませんでした。
St. Jude’s Children’s Research Hospitalの感染症部門責任者でMK-1654-004試験およびMK-1654-007試験の治験責任医師であるOctavio Ramilo(オクタビオ・ラミーロ)博士は、「RSウイルス感染症は、健康な乳児もリスクを有する乳児も感染しうる、広く分布する季節性の感染症で、乳児の入院の主な原因となっています。MK-1654-004試験では、外来対応の軽症から入院が必要な重症なケースまで幅広いRSウイルス感染症を評価しました。今回の有望な結果では、入院を含めRSウイルス感染症の発生率の低下が認められ、クレスロビマブが乳児やご家族が直面するRSウイルスの継続的な負担を軽減するという、重要な役割を担う可能性が示されました」と述べています。
本試験の有効性の主要評価項目として、投与後150日目(5カ月目)までにRSウイルス関連の医療介入が必要となった下気道感染症(MALRI: medically attended lower respiratory infections)(下気道感染症(LRI)または重症度の指標が1つ以上)の発生率をプラセボと比較したところ、60.4%(95% CI: 44.1, 71.9, p<0.001)低下しました。またクレスロビマブでは、150日目(5カ月目)までのRSウイルス関連の入院(副次評価項目)およびRSウイルス関連のLRIによる入院(三次評価項目)についても、プラセボと比較してそれぞれ84.2%(95% CI: 66.6, 92.6, p<0.001)、90.9%(95% CI: 76.2, 96.5)低下しました。クレスロビマブの投与により、重症のMALRIの発生率(三次評価項目)が91.7%(95% CI: 62.9, 98.1)低下しました。
さらに、事後解析において、MALRI(LRIおよび重症度の指標が2つ以上)(主要評価項目のMALRIのより重症度の高いMALRIを評価)の150日目(5カ月目)までの発生率は、88.0%(95% CI: 76.1, 94.0)低下しました。
MK-1654-004試験におけるRSウイルス感染症の負担に関するデータの詳細は、次の表のとおりです(疾患重症度の高い順)。
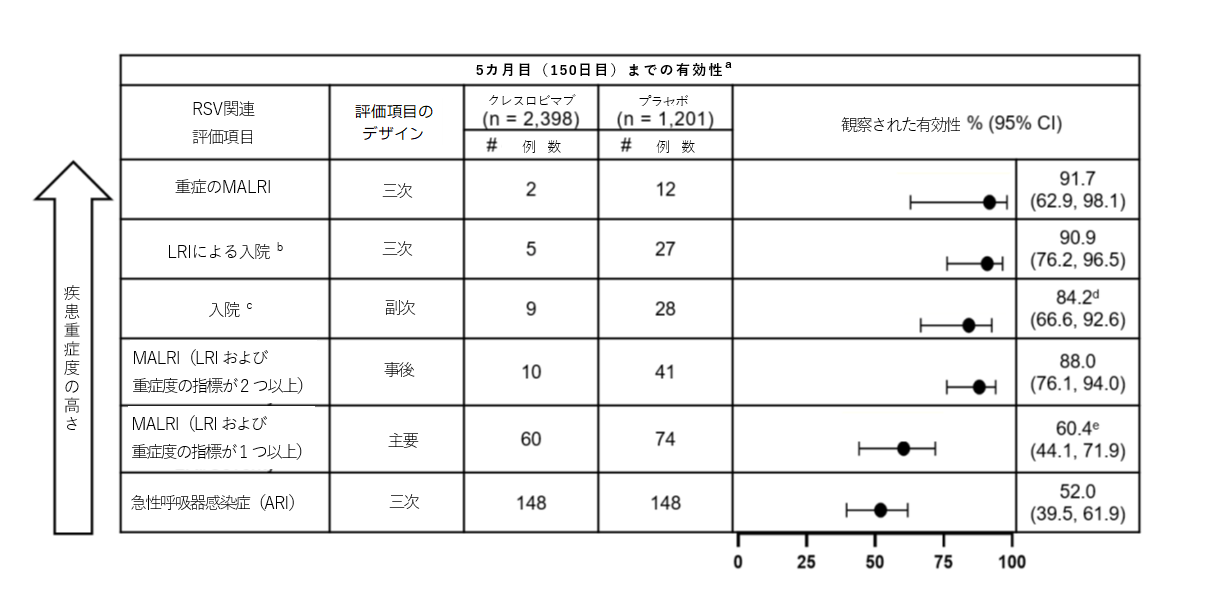
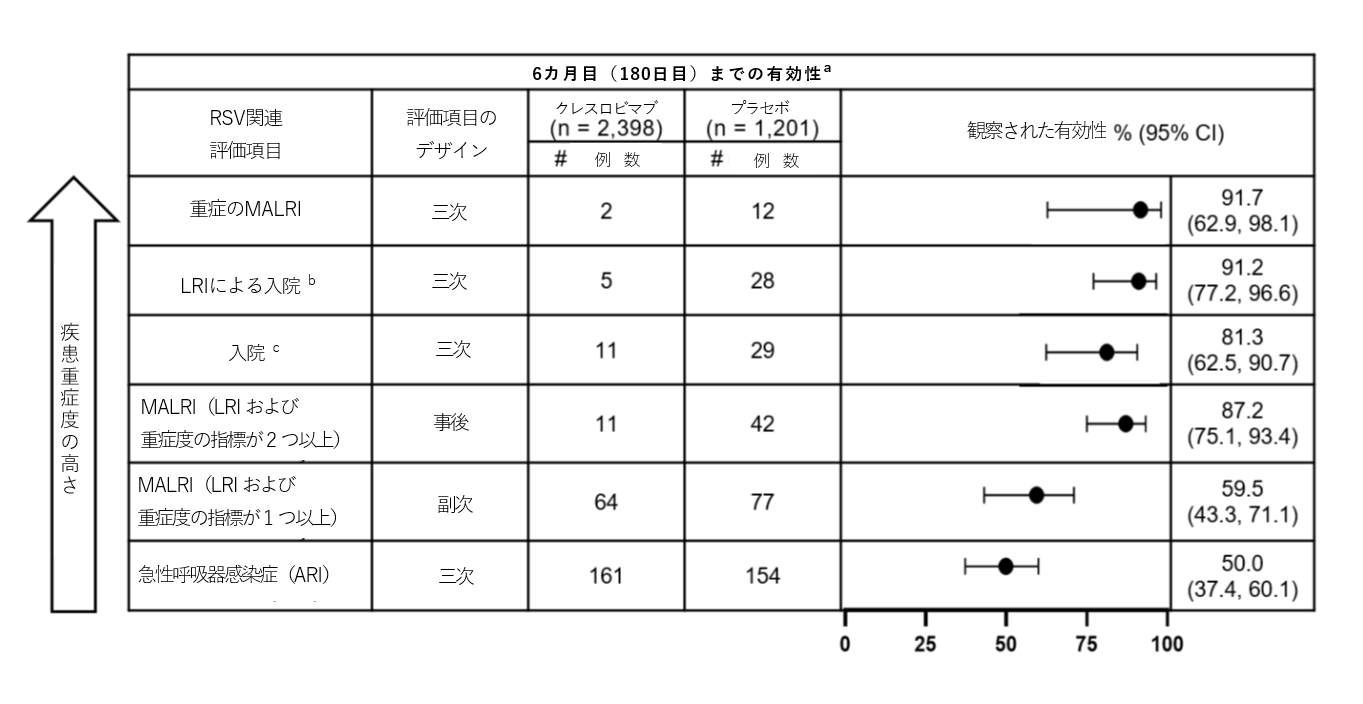
a. 最大の解析対象集団(FAS)
b. LRIによる入院の定義:PCR検査でRSウイルス陽性で、かつ呼吸器疾患で入院し、かつ咳または呼吸困難があり、かつ喘鳴、胸壁の引き込み/陥凹、ラ音/断続性ラ音、低酸素血症、頻呼吸、呼吸器症状による脱水症状のうち1つ以上の症状を有する
c. RSウイルス関連の入院の定義:PCR検査でRSウイルス陽性で、かつ呼吸器疾患で入院
d. 副次評価項目、p<0.001(基準=95%信頼区間の下限値 >0%)
e. 主要評価項目、p<0.001(基準=95%信頼区間の下限値 >25%)
略語:LRI=Lower Respiratory Infection(下気道感染症)、MALRI=Medically Attended Lower Respiratory Infection(医療介入が必要となった下気道感染症)、ARI=Acute Respiratory Infection(急性呼吸器感染症)
Merck & Co., Inc., Rahway, NJ, USAは、RSウイルス感染症の重症化リスクの高い乳児および小児を対象にクレスロビマブの安全性と有効性をパリビズマブと比較する第3相試験MK-1654-007試験の計画された中間解析のデータも発表しました。この試験の主要評価項目は、生後初回のRSウイルス感染流行期を迎える乳児に対するクレスロビマブの安全性と忍容性です。中間解析の結果では、クレスロビマブの安全性プロファイルはパリビズマブと同程度で、薬剤関連の重篤な有害事象はこれまで報告されていません。150日目(5カ月目)までのRSウイルス関連のMALRI(LRIまたは重症度の指標が1つ以上)およびRSウイルス関連の入院の発生率(いずれも副次評価項目)も、クレスロビマブ(それぞれ3.6%、1.3%)とパリビズマブ(それぞれ3.0%、1.5%)で同程度でした。
当社研究開発本部のグローバル臨床開発部門感染症・ワクチン領域のシニアバイスプレジデントであるPaula Annunziato(ポーラ・アヌンジアート)博士は、「IDWeekで発表された広範なデータでは、RSウイルスが乳児やご家族に与えうる大きな影響、そして高い感染率や入院率による医療体制への負担をクレスロビマブが軽減する可能性があることが示されています。臨床的に意味のある今回の結果は、クレスロビマブが健康な乳児とリスクの高い乳児の両方に対し、体重に関わらず1回の投与で感染を予防できるよう設計された唯一かつ初めての予防薬となる可能性も示しています。このデータについて世界中の保健当局と引き続き協議し、早ければ2025〜26年のRSウイルス流行期にクレスロビマブを乳児に提供したいと考えています」と述べています。
MK-1654-004試験について
MK-1654-004(NCT04767373)試験は、生後初回のRSウイルス感染流行期を迎える生後1歳までの健康な早産児および正期産児を対象としてクレスロビマブの安全性と有効性を評価する二重盲検無作為化プラセボ対照第2b/3相臨床試験です。この試験では3,632名を、初日に固定用量のクレスロビマブを単回投与(105 mgを筋注(IM))する群とプラセボ群に2:1の割合で無作為に割り付けました。主要評価項目は、初日(投与後)から150日目までにRSウイルス関連の医療介入が必要となった下気道感染症(MALRI)の発生率のプラセボとの比較、および安全性などでした。MALRIは、LRIまたは重症度の指標が1つ以上該当する場合と定義されました。150日目までのRSウイルス関連の入院および180日目までのMALRI(LRIまたは重症度の指標が1つ以上)が事前に規定された副次評価項目でした。事前に規定された三次評価項目は、150日目までの急性呼吸器感染症、RSウイルス関連の下気道感染による入院、重症のMALRIの発生率などでした。事後解析において、より重症度の高いRSウイルス関連のMALRI(LRIおよび重症度の指標が2つ以上)の評価を実施しました。すべての評価項目において、有効性の評価項目についても180日目まで評価しました。安全性の評価項目は、依頼に基づき非自発的に報告される注射関連の有害事象(AE)、特に注目すべき有害事象(AESI)、非自発的に報告される全身性有害事象または重篤な有害事象(SAE)の発現率などでした。
MK-1654-007試験について
MK-1654-007(NCT04938830)試験は、RSウイルス感染症の重症化リスクの高い乳児および小児に対するクレスロビマブの安全性、有効性、薬物動態をパリビズマブと比較評価する第3相多施設共同無作為化部分盲検対照試験です。この試験では、生後初回のRSウイルス感染流行期を迎え、早産(在胎35週以下)、早産児の慢性肺疾患(CLD)、または血行動態に異常のある先天性心疾患(CHD)によりパリビズマブの投与が推奨される被験者を登録しました。被験者は、生後初回の流行期に、クレスロビマブ105 mgを初日に筋肉内投与し、28日目にプラセボを投与する群または月1回パリビズマブを投与する群に1:1の割合で無作為に割り付け、対象となる被験者については生後2回目のRSウイルス感染流行期にクレスロビマブ210 mgを筋肉内投与しました。この中間解析時点において、901名の被験者が本試験に登録していました。主要評価項目は、生後初回の流行期における、パリビズマブと比較したクレスロビマブの安全性と忍容性です。副次評価項目は、150日目までにRSウイルス関連の医療介入が必要となった下気道感染症(MALRI)(LRIまたは重症度の指標が1つ以上)およびRSV関連の入院の発生率などです。
RSウイルスについて
RSウイルスは、インフルエンザのように広く季節性感染を引き起こす伝染性のウイルスで、世界中で幼児や高齢者の負担となっています。健康な乳児、リスクの高い乳児ともに、予防の選択肢が限定的でアンメットニーズが存在しています。RSウイルスは世界中で1歳未満の健康な乳児の入院の主な原因となっています。RSウイルスは細気管支炎や肺炎といった重篤な呼吸器疾患に至る可能性があり、世界中で推定101,000人の5歳未満の小児の死亡の原因となっています。CDCによると、米国のほとんどの地域でRSウイルスの流行期は秋に始まり冬にピークを迎えますが、各コミュニティーや地域でそのタイミングや重症度は年により異なる場合があります。
Merck & Co., Inc., Rahway, NJ, USAについて
Merck & Co., Inc., Rahway, NJ, USA(米国とカナダ以外ではMSD)は、最先端のサイエンスを駆使して、世界中の人々の生命を救い、生活を改善するというパーパスのもとに結束しています。130年以上にわたり、重要な医薬品やワクチンの発見を通して人類に希望をもたらしてきました。私たちは、世界トップクラスの研究開発型バイオ医薬品企業を目指し、人類や動物の疾患予防や治療に寄与する革新的なヘルスケア・ソリューションを提供するために、研究開発の最前線で活動しています。私たちは、多様かつ包括的な職場環境を醸成し、世界中の人々と地域社会に、安全で持続可能かつ健康な未来をもたらすため、責任ある経営を日々続けています。詳細については、当社ウェブサイトやX(旧Twitter)、Facebook、Instagram、YouTube、LinkedInをご参照ください。
Merck & Co., Inc., Rahway, NJ, USAの将来に関する記述
このニュースリリースには、米国の1995年私的証券訴訟改革法(the Private Securities Litigation Reform Act of 1995)の免責条項で定義された「将来に関する記述」が含まれています。これらの記述は、Merck & Co., Inc., Rahway, NJ, USAの経営陣の現時点での信条と期待に基づくもので、相当のリスクと不確実性が含まれています。新薬パイプラインに対する承認取得またはその製品化による収益を保証するものではありません。予測が正確性に欠けていた場合またはリスクもしくは不確実性が現実化した場合、実際の成果が、将来に関する記述で述べたものと異なる場合も生じます。
リスクと不確実性には、業界の一般的な状況および競争環境、金利および為替レートの変動などの一般的な経済要因、医薬品業界の規制やヘルスケア関連の米国法および国際法が及ぼす影響、ヘルスケア費用抑制の世界的な傾向、競合他社による技術的進歩や新製品開発および特許取得、承認申請などの新薬開発特有の問題、Merck & Co., Inc., Rahway, NJ, USAによる将来の市況予測の正確性、製造上の問題または遅延、国際経済および政府の信用リスクなどの金融不安、画期的製品に対するMerck & Co., Inc., Rahway, NJ, USAの特許権やその他の保護の有効性への依存、特許訴訟や規制措置の対象となる可能性等がありますが、これらに限定されるものではありません。
Merck & Co., Inc., Rahway, NJ, USAは、新たな情報、新たな出来事、その他いかなる状況が加わった場合でも、将来に関する記述の更新を行う義務は負いません。将来に関する記述の記載と大きく異なる成果を招くおそれがあるこの他の要因については、Merck & Co., Inc., Rahway, NJ, USAに関するForm 10-Kの2023年度年次報告書および米国証券取引委員会(SEC)のインターネットサイト(www.sec.gov)で入手できるSECに対するその他の書類で確認できます。
###
MSDについて
MSD(Merck & Co., Inc., Rahway, NJ, USAが米国とカナダ以外の国と地域で事業を行う際に使用している名称)は、「最先端のサイエンスを駆使して、世界中の人々の生命を救い、生活を改善する」というパーパスのもとに結束し、130年以上にわたり、重要な医薬品やワクチンの開発を通して人類に希望をもたらしてきました。私たちは、世界トップクラスの研究開発型バイオ医薬品企業を目指し、人類や動物の疾患予防や治療に寄与する革新的なヘルスケア・ソリューションを提供するために、研究開発の最前線で活動しています。また、私たちは、多様かつ包括的な職場環境を醸成し、世界中の人々と地域社会に安全で持続可能かつ健康な未来をもたらすため、責任ある経営を日々行っています。MSDの詳細については、弊社ウェブサイト(www.msd.co.jp)やFacebook、Instagram、YouTubeをご参照ください。
