KEYTRUDA®(ペムブロリズマブ)、局所進行または転移性食道がんおよび食道胃接合部(GEJ)がんに対するプラチナ製剤およびフッ化ピリミジン系製剤との併用療法がFDAの承認を取得 組織型やPD-L1発現の有無にかかわらず食道がんおよびGEJがんの一次治療において化学療法との併用療法が承認された初の抗PD-1抗体
April 1, 2021 12:00 am ET
報道関係各位
MSD株式会社
この参考資料は、 FDA Approves Merck’s KEYTRUDA® (pembrolizumab) Plus Platinum- and Fluoropyrimidine-Based Chemotherapy for Treatment of Certain Patients With Locally Advanced or Metastatic Esophageal or Gastroesophageal Junction (GEJ) Carcinoma の日本語訳であり、内容や解釈については英語が優先されます。適応症と安全性情報も米国のものであり、日本国内の情報ではありません。
KEYTRUDA®は、日本ではキイトルーダ®として、悪性黒色腫、切除不能な進行・再発の非小細胞肺癌、再発又は難治性の古典的ホジキンリンパ腫、がん化学療法後に増悪した根治切除不能な尿路上皮癌、がん化学療法後に増悪した進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する固形癌(標準的な治療が困難な場合に限る)、根治切除不能又は転移性の腎細胞癌、再発又は遠隔転移を有する頭頸部癌、がん化学療法後に増悪したPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌に対する効能又は効果で承認を取得しております。
参考資料
KEYTRUDA®(ペムブロリズマブ)、
局所進行または転移性食道がんおよび食道胃接合部(GEJ)がんに対する
プラチナ製剤およびフッ化ピリミジン系製剤との併用療法がFDAの承認を取得
組織型やPD-L1発現の有無にかかわらず
食道がんおよびGEJがんの一次治療において
化学療法との併用療法が承認された初の抗PD-1抗体
2021年3月23日 ニュージャージー州ケニルワース―Merck & Co., Inc., Kenilworth, N.J., U.S.A.(米国とカナダ以外ではMSD)は本日、抗PD-1抗体KEYTRUDA®が、外科的切除や根治的化学放射線療法が適さない局所進行または転移性食道がんおよび食道胃接合部(GEJ)がん(腫瘍の中心が食道胃接合部の上1〜5cmにあるもの)に対するプラチナ製剤およびフッ化ピリミジン系製剤との併用療法として米国食品医薬品局(FDA)の承認を取得したことを発表しました。このたびの承認は、第3相KEYNOTE-590試験で、組織型やPD-L1発現の有無にかかわらず、KEYTRUDA®とフルオロウラシル(FU)/シスプラチンの併用療法により、FU/シスプラチンのみの場合と比較して全生存期間(OS)、無増悪生存期間(PFS)、奏効率(ORR)が有意に改善したことに基づくものです。KEYTRUDA®+FU/シスプラチン群ではFU/シスプラチンのみの群と比較して、OSについては死亡のリスクが27%低下(HR=0.73 [95% CI, 0.62-0.86]; p<0.0001)し、PFSについては疾患進行または死亡のリスクが35%低下(HR=0.65 [95% CI, 0.55-0.76]; p<0.0001)しました。有効性の副次評価項目であるORRは、KEYTRUDA®+FU/シスプラチン群では45%(95% CI, 40-50)、FU/シスプラチン群では29%(95% CI, 25-34)でした(p<0.0001)。
重篤な、または死亡にいたる可能性のある免疫関連有害事象は、どの器官系や組織にも発生する可能性があり、複数の体組織に同時に影響する場合があります。KEYTRUDA®による治療中または治療後のあらゆる時点で、肺臓炎、大腸炎、肝炎、内分泌疾患、腎炎、皮膚反応、実質臓器移植の拒絶反応、同種造血幹細胞移植の合併症など、免疫関連の有害事象が発生する可能性があります。KEYTRUDA®の安全な使用のためには、免疫関連有害事象の早期発見と管理が重要です。有害事象の重症度に応じてKEYTRUDA®の投与を休薬または中止し、適宜コルチコステロイドを投与します。KEYTRUDA®は重篤な、または命にかかわるinfusion reactionを引き起こす場合があります。作用機序により、妊婦への投与は胎児に害をおよぼす場合があります。
Dana-Farber/Brigham and Women’s Cancer CenterのCenter for Esophageal and Gastric Cancerのディレクター、Peter Enzinger博士は、「食道がんの生存率は一般的に低く、新しい一次治療が喫緊に求められています。本日の承認取得により、KEYTRUDA®は、PD-L1発現の有無や腫瘍の組織型にかかわらず、FU/シスプラチンのみの場合よりも生存期間を改善すると認められた治療法として、外科的切除や根治的化学放射線療法が適さない局所進行または転移性食道がんまたはGEJがんと新たに診断される患者さんに対する新しい治療の選択肢となります」と述べています。
当社研究開発本部シニアバイスプレジデント、グローバル臨床開発責任者でチーフメディカルオフィサーのRoy Baynes博士は、「過去30年間、食道がんの一次治療における生存期間の改善に進展はほとんどありませんでした。当社は患者さんを第一に考え、がん患者さんの生存期間を延長できるような新たな治療に向けた研究を続けています。この試験に参加してくださった患者さん、介護者や医療従事者の皆さまに感謝します」と述べています。
この承認は、FDAが試験的に実施しているReal-Time Oncology Review(RTOR)と、国際提携によるがん治療薬の同時審査の枠組みを提供するFDA Oncology Center of Excellenceが進めるプロジェクトProject Orbisに基づいて審査されました。このプロジェクトで、FDA、オーストラリアTGA(薬品・医薬品行政局) 、Health Canada(カナダ保健省)、Swissmedic(スイス医薬品局)が共同でKEYNOTE-590試験に基づく申請の審査を行いました。オーストラリア、カナダ、スイスでは現在も審査が進行中です。
承認の根拠となったデータ
この承認は、外科的切除または根治的化学放射線療法の対象とならない、転移性または局所進行食道がんまたは食道胃接合部がん(腫瘍の中心が食道胃接合部の上1〜5cmにあるもの)の患者749名を対象とする、多施設共同無作為化プラセボ対照試験、KEYNOTE-590(ClinicalTrials.gov:NCT03189719)のデータに基づくものです。患者は、KEYTRUDA®(200 mgを3週間サイクルの初日)またはプラセボ(3週間サイクルの初日)を、シスプラチン(80 mg/m2を3週間サイクルの初日、最大6サイクル)+FU(1日あたり800 mg/m2を3週間サイクルの1〜5日目、または各施設におけるFUの標準投与法に従い、最大24カ月)と共に静脈内投与する群に無作為(1:1)に割り付けられました。
無作為化は腫瘍の組織型(扁平上皮がん、腺がん)、地域(アジア、その他の地域)、ECOGパフォーマンスステータス(0、1)により層別化されました。
KEYTRUDA®または化学療法による治療は、容認できない毒性または疾患進行が認められるまで継続しました。疾患進行のない患者では最長24カ月までKEYTRUDA®による治療を継続しました。主要評価項目はRECIST v 1.1に基づいて治験責任医師が判定したOSとPFSでした(標的病変は合計で最大10病変かつ臓器ごとに最大5病変までに変更)。OSとPFSは、事前に設定された解析において、扁平上皮がんの患者、CPS≧10の患者、全患者で評価を実施しました。副次評価項目は治験責任医師がRECIST v 1.1に基づき判定したORRおよび奏効期間(DOR)でした(標的病変は合計で最大10病変かつ臓器ごとに最大5病変までに変更)。
試験集団特性の内訳は以下のとおりです。年齢の中央値63歳(範囲:27〜94歳)、65歳以上43%、男性83%、白人37%、アジア人53%、黒人1%、ECOG PS 0患者40%、ECOG PS 1患者60%。91%の患者がM1、9%がM0でした。組織型では、73%が扁平上皮がん、27%が腺がん患者でした。
この試験では、KEYTRUDA®と化学療法の併用療法群では、化学療法のみの群と比較して、OSとPFSに統計学的に有意な改善が認められました。認められた有効性は以下の通りです。
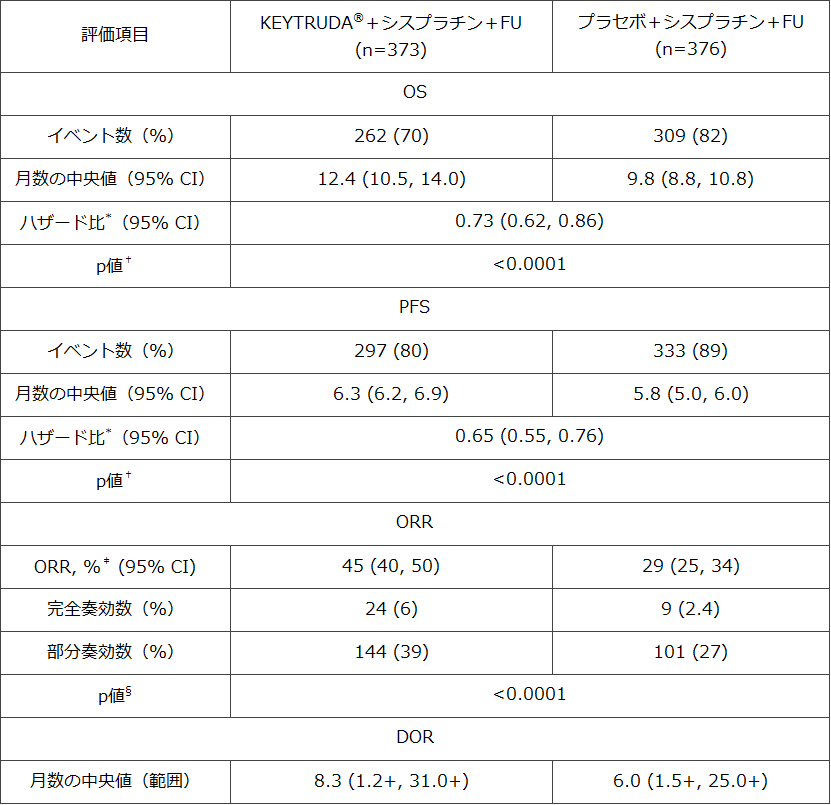
* 層別Cox比例ハザードモデルに基づく
† 層別ログランク検定に基づく
‡ 完全奏効または部分奏効が確定された例
§ 層別Miettinen-Nurminen法に基づく
PD-L1がCPS≧10の患者(383例)を対象とする事前に設定された正式なOSの解析において、中央値はKEYTRUDA®群が13.5カ月(95% CI, 11.1-15.6)、プラセボ群が9.4カ月(95% CI, 8.0-10.7)で、HRは0.62(95% CI, 0.49-0.78; p<0.0001)でした。探索的解析では、PD-L1がCPS<10の患者(347例)のOSの中央値はKEYTRUDA®群が10.5カ月(95% CI, 9.7-13.5)、プラセボ群が10.6カ月(95% CI, 8.8-12.0)で、HRは0.86(95% CI, 0.68-1.10)でした。
この試験における投与期間の中央値は、KEYTRUDA®併用療法群が5.7カ月(範囲:1日〜26カ月)で化学療法群が5.1カ月(範囲:3日〜27カ月)でした。15%の患者が有害事象によりKEYTRUDA®による治療を中断しました。KEYTRUDA®の完全な中止にいたった有害事象で最も頻度が高かった(1%以上)のは、肺臓炎(1.6%)、急性腎不全(1.1%)、肺炎(1.1%)でした。67%の患者が有害事象によりKEYTRUDA®による治療を中断しました。
KEYTRUDA®の中断にいたった有害事象で最も高頻度(2%以上)で認められたのは、好中球減少症(19%)、疲労/無力症(8%)、白血球数の減少(5%)、肺炎(5%)、食欲減退(4.3%)、貧血(3.2%)、血液中のクレアチニン値の上昇(3.2%)、口内炎(3.2%)、倦怠感(3.0%)、血小板減少症(3%)、肺臓炎(2.7%)、下痢(2.4%)、嚥下障害(2.2%)、吐気(2.2%)でした。KEYTRUDA®+化学療法併用群で最も高頻度(全グレード、20%以上)で認められたのは、悪心(67%)、疲労(57%)、食欲減退(44%)、便秘(40%)、下痢(36%)、嘔吐(34%)、口内炎(27%)、体重減少(24%)でした。
食道がんについて
食道がんは、食道の内側の層(粘膜)に発生し、外側に向かって増殖します。食道がんは世界で8番目に多いがんで、がんによる死亡原因の第6位となっています。米国では新たに診断される食道がんの約67%が腺がんで33%が扁平上皮がんです。2021年には米国で約19,260人が新たに食道がんと診断され、約15,530人が食道がんにより死亡すると推定されています。
KEYTRUDA®について
KEYTRUDA®は、自己の免疫力を高め、がん細胞を見つけて攻撃するのを助ける抗PD-1抗体です。KEYTRUDA®はPD-1とそのリガンドであるPD-L1およびPD-L2との相互作用を阻害して、がん細胞を攻撃するT リンパ球を活性化するヒト化モノクローナル抗体です。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.は業界最大のがん免疫療法臨床研究プログラムを行っており、現在1,400を超えるKEYTRUDA®の臨床試験を実施し、幅広い種類のがんや治療セッティングを検討しています。KEYTRUDA®の臨床プログラムでは、さまざまながんにおけるKEYTRUDA®の役割や、KEYTRUDA®による治療効果が得られる可能性を予測する因子について模索しており、さまざまなバイオマーカーの模索も行っています。
KEYTRUDA®用法・用量・安全性情報・Access Program・患者支援プログラムについて
用法・用量・安全性情報・Access Program・患者支援プログラムなど一部情報は米国のもので、日本の情報ではありません。詳しくは当社英文リリースをご参照ください。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.のがん領域における取り組み
Merck & Co., Inc., Kenilworth, N.J., U.S.A.では、画期的な科学を革新的ながん治療薬に変換して世界中のがん患者さんを助けることに取り組んでいます。当社のオンコロジー事業にとって、がんと闘う人々を助けることは私たちの情熱であり、がん治療薬へアクセスしやすくすることは私たちの責任です。また、がん領域における取り組みの一環として、医薬品業界で一二を争う急成長を遂げている開発プログラムにより、30種類以上のがんに対するがん免疫療法の可能性を模索しています。また、引き続き戦略的買収を通じてポートフォリオを強化し、進行がんの治療を改善する可能性をもつ有望ながん治療薬候補の開発を最優先に進めています。当社のオンコロジー臨床試験について詳しくは、![]() 当社ウェブサイトをご覧ください。
当社ウェブサイトをご覧ください。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.について
Merck & Co., Inc., Kenilworth, N.J., U.S.A.(米国とカナダ以外ではMSD)は130年にわたり、人々の生命を救い、人生を健やかにするというミッションのもと、世界で最も治療が困難な病気のために、革新的な医薬品やワクチンの発見、開発、提供に挑みつづけてきました。また、多岐にわたる政策やプログラム、パートナーシップを通じて、患者さんの医療へのアクセスを推進する活動に積極的に取り組んでいます。私たちは、今日、がん、HIVやエボラといった感染症、そして新たな動物の疾病など、人類や動物を脅かしている病気の予防や治療のために、研究開発の最前線に立ち続け、世界最高の研究開発型バイオ医薬品企業を目指しています。詳細については、![]() 当社ウェブサイトや
当社ウェブサイトや![]() Twitter、
Twitter、![]() Facebook、
Facebook、![]() Instagram、
Instagram、![]() YouTube、
YouTube、![]() LinkedInをご参照ください。
LinkedInをご参照ください。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.の将来に関する記述
このニュースリリースには、米国の1995年私的証券訴訟改革法(the Private Securities Litigation Reform Act of 1995)の免責条項で定義された「将来に関する記述」が含まれています。これらの記述は、Merck & Co., Inc., Kenilworth, N.J., U.S.A.の経営陣の現時点での信条と期待に基づくもので、相当のリスクと不確実性が含まれています。新薬パイプラインに対する承認取得またはその製品化による収益を保証するものではありません。予測が正確性に欠けていた場合またはリスクもしくは不確実性が現実化した場合、実際の成果が、将来に関する記述で述べたものと異なる場合も生じます。
リスクと不確実性には、業界の一般的な状況および競争環境、金利および為替レートの変動などの一般的な経済要因、昨今の新型コロナウイルス感染症(COVID-19)の世界的大流行の影響、医薬品業界の規制やヘルスケア関連の米国法および国際法が及ぼす影響、ヘルスケア費用抑制の世界的な傾向、競合他社による技術的進歩や新製品開発および特許取得、承認申請などの新薬開発特有の問題、Merck & Co., Inc., Kenilworth, N.J., U.S.A.による将来の市況予測の正確性、製造上の問題または遅延、国際経済および政府の信用リスクなどの金融不安、画期的製品に対するMerck & Co., Inc., Kenilworth, N.J., U.S.A.の特許権やその他の保護の有効性への依存、特許訴訟や規制措置の対象となる可能性等がありますが、これらに限定されるものではありません。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.は、新たな情報、新たな出来事、その他いかなる状況が加わった場合でも、将来に関する記述の更新を行う義務は負いません。将来に関する記述の記載と大きく異なる成果を招くおそれがあるこの他の要因については、Merck & Co., Inc., Kenilworth, N.J., U.S.A.に関するForm 10-Kの2020年度年次報告書および米国証券取引委員会(SEC)のインターネットサイト(www.sec.gov)で入手できるSECに対するその他の書類で確認できます。
# # #
MSDについて
MSD(Merck & Co., Inc., Kenilworth, N.J., U.S.A.が米国とカナダ以外の国と地域で事業を行う際に使用している名称)は、130年にわたり、人々の生命を救い、人生を健やかにするというミッションのもと、世界で最も治療が困難な病気のために、革新的な医薬品やワクチンの発見、開発、提供に挑みつづけてきました。MSDはまた、多岐にわたる政策やプログラム、パートナーシップを通じて、患者さんの医療へのアクセスを推進する活動に積極的に取り組んでいます。私たちは、今日、がん、HIVやエボラといった感染症、そして新たな動物の疾病など、人類や動物を脅かしている病気の予防や治療のために、研究開発の最前線に立ち続けています。MSDは世界最高の研究開発型バイオ医薬品企業を目指しています。MSDの詳細については、弊社ウェブサイト(![]() www.msd.co.jp)や
www.msd.co.jp)や![]() Facebook、
Facebook、![]() Twitter、
Twitter、![]() YouTubeをご参照ください。
YouTubeをご参照ください。
