LYNPARZA®(オラパリブ)、第3相試験OlympiAにおいて生殖細胞系列BRCA変異陽性の高リスクHER2陰性早期乳がん患者に対する術後補助療法として、浸潤がんの再発または死亡のリスクがプラセボと比較して42%低減 BRCA遺伝子変異を特異的に標的とする薬剤で初めて根治的局所治療および術前補助化学療法または術後補助化学療法を完了した患者への術後補助療法として無浸潤生存期間を統計学的に有意に延長
2021/06/11 00:01 JST
報道関係各位
MSD株式会社
この参考資料は、LYNPARZA® (olaparib) Reduced the Risk of Invasive Disease Recurrence or Death by 42% Versus Placebo in Adjuvant Treatment of Patients With Germline BRCA Mutations and High-Risk HER2-Negative Early Breast Cancer in Phase 3 OlympiA Trial の日本語訳であり、内容や解釈については英語が優先されます。適応症と安全性情報も米国のものであり、日本国内の情報ではありません。
LYNPARZA®は、日本ではリムパーザ®として、白金系抗悪性腫瘍剤感受性の再発卵巣癌における維持療法、BRCA遺伝子変異陽性の卵巣癌における初回化学療法後の維持療法、相同組換え修復欠損を有する卵巣癌におけるベバシズマブ(遺伝子組換え)を含む初回化学療法後の維持療法、がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌、BRCA遺伝子変異陽性の遠隔移転を有する去勢抵抗性前立線癌、BRCA遺伝子変異陽性の治療切除不能な膵癌における白金系抗悪性腫瘍剤を含む化学療法後の維持療法に対する効能又は効果で承認を取得しております。
参考資料
LYNPARZA®(オラパリブ)、第3相試験OlympiAにおいて
生殖細胞系列BRCA変異陽性の高リスクHER2陰性早期乳がん患者に対する
術後補助療法として、浸潤がんの再発または死亡のリスクがプラセボと比較して42%低減
BRCA遺伝子変異を特異的に標的とする薬剤で初めて
根治的局所治療および術前補助化学療法または術後補助化学療法を完了した患者への
術後補助療法として無浸潤生存期間を統計学的に有意に延長
2021年6月3日 ニュージャージー州ケニルワース―AstraZenecaとMerck & Co., Inc., Kenilworth, N.J., U.S.A.(米国とカナダ以外ではMSD)は本日、第3相試験OlympiAのデータを初めて公表し、LYNPARZA®が根治的局所治療および術前補助化学療法または術後補助化学療法を完了した生殖細胞系列BRCA1/2変異陽性の高リスクヒト上皮成長因子受容体2(HER2)陰性早期乳がんに対する術後補助療法において、主要評価項目である無浸潤生存期間(iDFS)をプラセボと比較して統計学的に有意に延長したことを発表しました。この結果は、2021年米国臨床腫瘍学会(ASCO)年次総会のプレナリーセッションで6月6日に発表されます(アブストラクトLBA#1)。また、このデータは本日、The New England Journal of Medicine誌にも掲載されました。
2020年には世界で推定230万人が乳がんと診断され、乳がん患者の約5%にBRCA遺伝子の生殖細胞系列変異が認められています。
OlympiA試験は多施設共同無作為化二重盲検プラセボ対照第3相試験です。全1,836名の患者を対象とするこの試験では、事前に計画されたイベント発生状況に基づく中間解析(フォローアップ期間の中央値2.5年)で、LYNPARZA®(921例)はプラセボ(915例)と比較して浸潤性乳がんの再発、二次がんまたは死亡のリスクを42%低減しました(HR=0.58 [99.5% CI, 0.41-0.82]; p<0.0001)。試験開始から3年の時点で、浸潤性乳がんや二次がんのない状態での生存率はLYNPARZA®群では85.9%、プラセボ群では77.1%でした(群間差:8.8% [95% CI, 4.5-13.0])。
また主な副次評価項目である遠隔無病生存期間(DDFS)も試験対象集団全体で改善しました。LYNPARZA®では、遠隔転移再発または死亡のリスクが43%低減しました(HR=0.57 [99.5% CI, 0.39-0.83]; p<0.0001)。データカットオフ日における全生存期間(OS)は良好な傾向でしたが統計学的に有意な水準に到達せず、データは未成熟でした。この試験では引き続き副次評価項目としてOSを評価します。
本試験におけるLYNPARZA®の安全性および忍容性プロファイルは、これまでに報告されている試験の結果と一貫していました。最も高頻度に認められた有害事象(AE、20%以上)は、悪心(57%)、倦怠感(40%)、貧血(23%)、嘔吐(23%)でした。グレード3以上のAEは、貧血(9%)、好中球減少症(5%)、白血球減少症(3%)、倦怠感(2%)、悪心(1%)でした。LYNPARZA®を投与した患者の約10%がAEにより治療を中止しました。
第3相試験OlympiAの国際研究代表者でInstitute of Cancer ResearchおよびKings College LondonのAndrew Tutt教授は、「国際的な産学連携によるOlympiA試験において、BRCA1またはBRCA2遺伝子変異を有する早期乳がん患者さんに対する新たな治療の選択肢を模索できることを非常に嬉しく思います。BRCA遺伝子変異を有する早期乳がんは、遺伝子変異がない場合より若い年齢で診断されることの多い疾患です。オラパリブは、遺伝子検査でこれらの変異が確認された多くの患者さんに対し、乳がんのあらゆる一次標準療法後に投与することにより、命に関わる再発やがんの拡大を抑制できる可能性があります」と述べています。
アストラゼネカのエグゼクティブバイスプレジデント兼オンコロジービジネスユニット責任者であるDave Fredricksonは、「LYNPARZA®は、高リスク患者さんの乳がん再発リスクを大幅に抑制できる治療の新たな基準になりうると期待しています。規制当局と連携し、LYNPARZA®を一日も早く患者さんに届けられるよう取り組んでいます」と述べています。
当社研究開発本部のシニアバイスプレジデントでグローバル臨床開発部門の責任者、チーフメディカルオフィサーのRoy Baynes博士は、「OlympiA試験では、高リスクの早期乳がんに対する新たな治療の可能性が認められました。新たなデータでは、LYNPARZA®による術後補助療法が適切と考えられる早期乳がん患者さんを特定できるバイオマーカーとして、BRCA1/2遺伝子の検査を診断時に実施することが重要であることが示されています。ホルモン受容体やHER2タンパク発現に加え、BRCA遺伝子検査を実施することで、臨床現場において患者さんの治療計画を立てる上でのさらなる検討材料となります」と述べています。
OlympiA試験は2021年2月に独立データ監視委員会(IDMC)の推奨を受け、早期の主要解析および報告の段階に移行することを発表しました。事前に計画された中間解析に基づき、IDMCは、この試験で主要評価項目であるiDFSの優越性が示されたと結論づけました。
OlympiA試験の主な結果
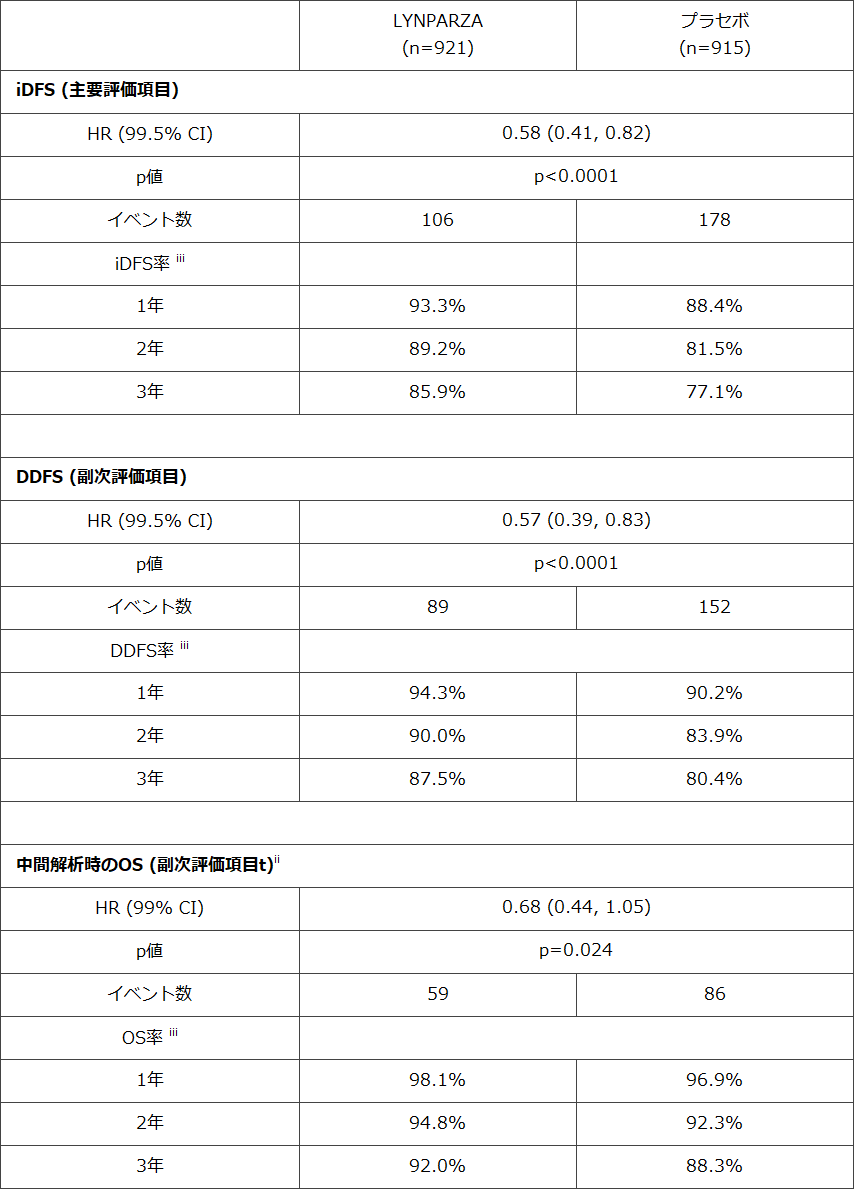
i 中間解析のデータカットオフ日は2020年3月27日でした。
ii 今後の生存期間の解析におけるαについて中間解析計画に基づく統計学的優位性は未達でした。
iii この試験は各時点における統計学的な群間差を評価するものではありません
OlympiA試験は、Breast International Group(BIG)が、NRG Oncology、U.S. National Cancer Institute(NCI)、Frontier Science & Technology Research Foundation(FSTRF)、AstraZeneca、Merck & Co., Inc., Kenilworth, N.J., U.S.A.とのパートナーシップにより国際的に統括するグローバル連携による第3相試験です。治験依頼者は米国ではNRG Oncology、その他の国ではAstraZenecaです。
LYNPARZA®については、化学療法およびホルモン受容体陽性の場合は適宜内分泌療法による治療歴のある生殖細胞系列BRCA変異陽性のHER2陰性転移性乳がん患者に対する適応が、米国、日本その他各国で承認されています。
LYNPARZA®用法・用量・安全性情報について
用法・用量・安全性情報など一部情報は米国のもので、日本の情報ではありません。詳しくは当社英文リリースをご参照ください。
乳がんについて
乳がんは世界的に、女性のがんのなかで最も罹患率の高いがんで、乳がんの推定70%が早期に診断されます。生物学的にとくに多様ながん種であり、その発生や進行には様々な要因がかかわっています。乳がんの発生にかかわるバイオマーカーの発見は、このがん種の科学的理解や乳がん患者の治療に大きな影響を及ぼしています。
BRCA遺伝子変異について
BRCA1およびBRCA2(乳がん感受性遺伝子1/2)は、損傷したDNAの修復を担うタンパクを生成する遺伝子であり、細胞の遺伝的安定性維持に重要な役割を果たします。これら遺伝子のいずれかに変異があるとBRCAタンパクが生成されない、または正常に機能せず、DNA損傷が適切に修復されず細胞が不安定になる可能性があります。その結果、細胞はがん化につながるさらなる遺伝子異常を起こす可能性が高くなります。
OlympiA試験について
OlympiA試験は、gBRCAm陽性の高リスクHER2陰性早期乳がんで、根治的局所治療および術前補助化学療法または術後補助化学療法を完了した患者さんを対象に、術後補助療法としてのLYNPARZA®錠の有効性および安全性をプラセボと比較検討する二重盲検並行群間比較プラセボ対照多施設共同第3相試験です。本試験の主要評価項目はiDFSで、無作為割り付けから最初の治療無効(局所領域再発、遠隔転移再発、新たながんの発生、または原因を問わない死亡)までの期間と定義されています。主な副次評価項目にはOSやDDFSが含まれ、無作為化割り付けから最初の遠隔再発まで、または遠隔再発を伴わない死亡までの期間と定義されています。
BIGについて
Breast International Group(BIG)は、ベルギーのブリュッセルに拠点を置く、乳がん学術研究グループのための国際非営利団体です。
1999年に、欧州の主要なオピニオンリーダーたちによって、乳がん研究がばらばらに進められている欧州の状況を改善するために設立され、現在では6大陸約70カ国の専門病院、研究センター、主要な専門家など50以上の研究グループが一つの志のもとに結集するネットワークとなっています。
BIGの研究は、「BIG against breast cancer」として知られている、慈善事業の支援を一部受けています。この慈善事業は、一般や寄贈者との交流、BIGの純粋に学術的な乳がんの試験や研究プログラムの資金を調達するために活用されています。
FSTRFについて
Frontier Science & Technology Research Foundation(FSTRF)は、研究ネットワークや製薬会社、治験責任医師が科学的に意義のある質の高い臨床試験を実施できるように支援する非営利研究機関です。OlympiA試験には、米国の研究スタッフとスコットランドにある関連拠点の研究スタッフが参加しました。
FSTRFは世界中の800を超える研究所、大学、医療センターの科学者や技術者と協力して、デザインや解析、報告など、臨床試験のプロセス全体にわたって包括的な研究サービスを提供しています。
この取り組みを通じて、FSTRFは、科学、医療および教育の分野における統計科学とその実践、データマネジメント技術の応用を前進させることを目指しています。
NRG Oncologyについて
NRG Oncologyは、National Institutes of Health(NIH、米国国立衛生研究所)傘下のNCI(国立がん研究所)の資金で活動するネットワークグループです。NRG Oncologyは、National Surgical Adjuvant Breast and Bowel Project(NSABP)、Radiation Therapy Oncology Group(RTOG)、Gynecologic Oncology Group(GOG)が一体となり、多施設共同臨床研究や橋渡し研究によって治療を変革し、がん患者さんの生活を向上させることを使命としています。NRG Oncologyは米国におけるOlympiA試験の治験依頼者であり、NCI、Alliance、ECOG/ACRIN、Southwest Oncology Groupが資金提供する他の成人がん臨床研究グループと連携しました。NCIとAstraZenecaは共同研究開発契約を締結して協業しています。
LYNPARZA ®(olaparib)について
LYNPARZA®はファーストインクラスのPARP阻害剤であり、BRCA遺伝子変異などDNA損傷応答(DDR)経路の異常に作用することで、がん細胞を選択的に死滅させる初の標的治療薬です。LYNPARZA®によるPARP阻害は、DNA一本鎖切断に結合するPARPを捕捉し、複製フォーク停止と崩壊を惹起することで、DNA二本鎖切断を起こしがん細胞を死滅させます。LYNPARZA®はDDR経路に異常をきたした一連のPARP依存性の腫瘍タイプにおいて試験が進行中です。
アストラゼネカとMerck & Co., Inc., Kenilworth, N.J., U.S.A(北米およびカナダ以外ではMSD)が共同で開発と商業化を行っているLYNPARZA®は、広範かつ最先端の臨床試験開発プログラムを有しており、両社は、さまざまながん種にわたり、LYNPARZA®が単剤療法および他の薬剤との併用療法として様々なPARP依存性腫瘍に及ぼす影響を解明するために協業しています。
アストラゼネカとMerck & Co., Inc., Kenilworth, N.J., U.S.A.のがん領域における戦略的提携について
2017年7月、英国アストラゼネカ社とMerck & Co., Inc., Kenilworth, N.J., U.S.A(北米およびカナダ以外ではMSD)は、世界初のPARP阻害剤であるLYNPARZA®を含む特定のがん治療薬について、複数のがん種において共同開発・商業化するがん領域における世界的な戦略的提携を発表しました。両社は、これらの薬剤を他の可能性のある新薬との併用療法および単剤療法として共同開発します。なお、これらのがん治療薬と、各々の会社が保有するPD-L1またはPD-1阻害薬との併用療法は各々の会社で開発します。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.のがん領域における取り組み
Merck & Co., Inc., Kenilworth, N.J., U.S.A. (米国とカナダ以外ではMSD)では、画期的な科学を革新的ながん治療薬に変換して世界中のがん患者さんを助けることに取り組んでいます。当社のオンコロジー事業にとって、がんと闘う人々を助けることは私たちの情熱であり、がん治療薬へアクセスしやすくすることは私たちの責任です。また、がん領域における取り組みの一環として、医薬品業界で一二を争う急成長を遂げている開発プログラムにより、30種類以上のがんに対するがん免疫療法の可能性を模索しています。また、引き続き戦略的買収を通じてポートフォリオを強化し、進行がんの治療を改善する可能性をもつ有望ながん治療薬候補の開発を最優先に進めています。当社のオンコロジー臨床試験について詳しくは、当社ウェブサイトをご覧ください。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.について
Merck & Co., Inc., Kenilworth, N.J., U.S.A.(米国とカナダ以外ではMSD)は130年にわたり、人々の生命を救い、人生を健やかにするというミッションのもと、世界で最も治療が困難な病気のために、革新的な医薬品やワクチンの発見、開発、提供に挑みつづけてきました。また、多岐にわたる政策やプログラム、パートナーシップを通じて、患者さんの医療へのアクセスを推進する活動に積極的に取り組んでいます。私たちは、今日、がん、HIVやエボラといった感染症、そして新たな動物の疾病など、人類や動物を脅かしている病気の予防や治療のために、研究開発の最前線に立ち続け、世界最高の研究開発型バイオ医薬品企業を目指しています。詳細については、当社ウェブサイトやTwitter、Facebook、Instagram、YouTube、LinkedInをご参照ください。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.の将来に関する記述
このニュースリリースには、米国の1995年私的証券訴訟改革法(the Private Securities Litigation Reform Act of 1995)の免責条項で定義された「将来に関する記述」が含まれています。これらの記述は、Merck & Co., Inc., Kenilworth, N.J., U.S.A.の経営陣の現時点での信条と期待に基づくもので、相当のリスクと不確実性が含まれています。新薬パイプラインに対する承認取得またはその製品化による収益を保証するものではありません。予測が正確性に欠けていた場合またはリスクもしくは不確実性が現実化した場合、実際の成果が、将来に関する記述で述べたものと異なる場合も生じます。
リスクと不確実性には、業界の一般的な状況および競争環境、金利および為替レートの変動などの一般的な経済要因、昨今の新型コロナウイルス感染症(COVID-19)の世界的大流行の影響、医薬品業界の規制やヘルスケア関連の米国法および国際法が及ぼす影響、ヘルスケア費用抑制の世界的な傾向、競合他社による技術的進歩や新製品開発および特許取得、承認申請などの新薬開発特有の問題、Merck & Co., Inc., Kenilworth, N.J., U.S.A.による将来の市況予測の正確性、製造上の問題または遅延、国際経済および政府の信用リスクなどの金融不安、画期的製品に対するMerck & Co., Inc., Kenilworth, N.J., U.S.A.の特許権やその他の保護の有効性への依存、特許訴訟や規制措置の対象となる可能性等がありますが、これらに限定されるものではありません。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.は、新たな情報、新たな出来事、その他いかなる状況が加わった場合でも、将来に関する記述の更新を行う義務は負いません。将来に関する記述の記載と大きく異なる成果を招くおそれがあるこの他の要因については、Merck & Co., Inc., Kenilworth, N.J., U.S.A.に関するForm 10-Kの2020年度年次報告書および米国証券取引委員会(SEC)のインターネットサイト(www.sec.gov)で入手できるSECに対するその他の書類で確認できます。
# # #
MSDについて
MSD(Merck & Co., Inc., Kenilworth, N.J., U.S.A.が米国とカナダ以外の国と地域で事業を行う際に使用している名称)は、130年にわたり、人々の生命を救い、人生を健やかにするというミッションのもと、世界で最も治療が困難な病気のために、革新的な医薬品やワクチンの発見、開発、提供に挑みつづけてきました。MSDはまた、多岐にわたる政策やプログラム、パートナーシップを通じて、患者さんの医療へのアクセスを推進する活動に積極的に取り組んでいます。私たちは、今日、がん、HIVやエボラといった感染症、そして新たな動物の疾病など、人類や動物を脅かしている病気の予防や治療のために、研究開発の最前線に立ち続けています。MSDは世界最高の研究開発型バイオ医薬品企業を目指しています。MSDの詳細については、弊社ウェブサイト(![]() www.msd.co.jp)や
www.msd.co.jp)や ![]() Facebook、
Facebook、![]() Twitter、
Twitter、![]() YouTube をご参照ください。
YouTube をご参照ください。
